聚乙烯醇(PVA)是一种用途广泛的水溶性有机高分子聚合物,具有良好的成膜性、耐磨性、抗静电性以及气体阻隔性,因此被广泛应用于纺织、建筑、造纸、食品、农业及医疗行业。随着近年来印染、纺织等行业的快速发展,PVA废水排放量逐年增加。PVA废水具有较大的表面活性,易产生泡沫,对水体的复氧会产生不利影响,另外PVA废水直接排放还会增强湖泊、海洋中重金属的活性,促进水中重金属的迁移,造成严重的环境污染]。因此,如何快速有效降解水中的PVA具有重要的实际意义。
PVA废水的处理方法有物理法、化学法和生物法。常见的物理法包括吸附法、膜分离法、萃取法等,化学法包括高级氧化法(AOPs)、电化学法、混凝法等,生物法包括好氧生物法、厌氧生物法以及好氧厌氧生物联用法等。其中,AOPs是一种利用•OH和•SO-4等自由基氧化难降解有机物的高效处理方法。由于这些自由基对富电子基的高亲和力以及对有机污染物的良好处理效果,AOPs被广泛应用于有机废水处理领Ⅱ。单独使用AOPs操作简单,处理效果好,但所需的反应时间较长,而在AOPs中加入金属离子催化剂能有效提高氧化效率,改善有机废水的处理效果。AOPs中加入金属离子催化剂处理PVA废水使用的装置一般为搅拌反应器,而利用超重力装置与AOPs工艺结合的方式来处理PVA废水的研究尚未有报道。
超重力技术是一种高效的过程强化技术,在吸收、解吸、精馏、纳米材料制备等领Ⅱ中得到了广泛的应用。超重力技术通过转子高速旋转所形成的离心力模拟超重力环境,将液体破碎成微小的液膜和液滴,并使气液、液液界面快速更新,从而使得传质和混合得到了极大的强化。将超重力技术与臭氧AOPs相结合处理石化、农药、印染废水的结果表明,该工艺可以达到快速降解有机物、改善废水可生化性、显著降低废水色度的效果。
本文首次提出将一种典型的超重力装置—旋转填充床(RPB)与金属离子均相催化臭氧AOPs相结合,进行模拟PVA废水的降解研究,考察了RPB中O3/Fe(Ⅱ)和O3/Fenton两种AOPs处理PVA废水的效果。利用超重力环境对PVA废水的高度分散作用来促进O3的气液传质过程,从而提高O3的吸收及其与PVA的反应效果,提升PVA的降解效率,以期为PVA废水的处理提供新的技术路线。
一、实验部分
1.1 实验材料及设备
PVA(≥99.0%)、KI(分析纯),国药集团化学试剂有限公司,H2O2、浓H2SO4、NaOH、H3BO3和I2,均为分析纯,北京化工厂,FeSO4•7H2O,分析纯,西陇化工股份有限公司。除非另有说明,所配制PVA溶液的初始浓度均为200mg/L,初始pH为5.7。实验中采用1mol/L的NaOH和1mol/L的H2SO4调节PVA溶液的pH值。
实验所使用的旋转填充床主要包括转子、液体分布器和外壳等。转子的内径40mm,外径120mm,轴向厚度15mm,其内部充填不锈钢丝网填料。转子带动填料旋转从而达到破碎和分散PVA废水的目的,强化气液传质过程。其他设备包括3S-A10型臭氧发生器(北京同林高科科技有限责任公司),台式双光路紫外臭氧浓度检测仪(广州立美臭氧技术开发中心),DR6000型紫外分光光度仪(美国哈希),PHSJ-3F雷磁数显pH计(上海精密科学仪器有限公司)等。
1.2 实验流程及条件
实验装置如图1所示,将配置好浓度的PVA溶液调节到所需的pH值,放入进液贮槽中,加入一定量的FeSO4•7H2O,启动RPB,再开启氧气瓶,调节气体流量为90L/h,待其稳定后打开臭氧发生器,产生的含O3气体经进气口进入RPB,通过填料后经出气口流出RPB,随后流经臭氧检测仪后排放。通过调节臭氧发生器的功率改变O3浓度,使臭氧检测仪的示数稳定在所需值。O3示数稳定后在进液贮槽中加入一定量的H2O2,同时立即打开蠕动泵通过进液口向RPB中通入PVA溶液,含O3气体与PVA溶液在填料中逆流接触完成O3的吸收和PVA的降解反应,而后剩余气体和处理后的PVA溶液分别从出气口和出液口排出。出气口的O3浓度通过臭氧检测仪检测,待其示数稳定时在出液口处对PVA溶液取样分析,考察PVA的降解效果。
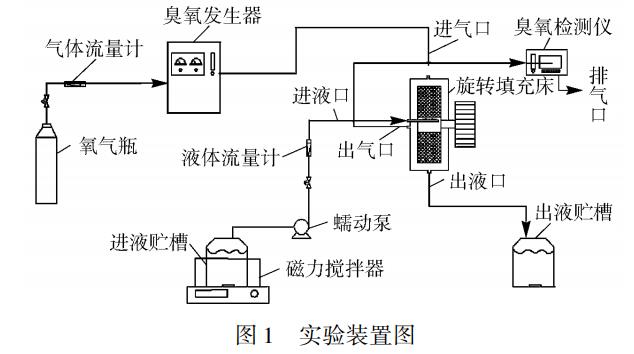
实验条件为:PVA质量浓度200mg/L,pH=5.7,温度25℃,液体流量30L/h,气体流量90L/h,RPB转速1000r/min,Fe2+浓度0.8mmol/L,O3/Fe(Ⅱ)工艺O3质量浓度50mg/L(反应温度为变量时O3质量浓度为60mg/L),O3/Fenton工艺O3质量浓度30mg/L,H2O2质量浓度35mg/L。当考察某一因素的影响时,则将其设为变量。
1.3 分析方法
PVA的降解效果用降解率表示。PVA的浓度采用紫外-可见分光光度法进行检测:PVA会与KI-I2和H3BO3的混合溶液生成蓝绿色的络合物,此络合物在波长690nm处有一最大吸收峰,通过测量其吸光度可以求出PVA的含量并作出标准曲线。
通过得到的标准工作曲线将待测PVA溶液的吸光度转换成浓度。降解率浊的计算公式为

式中,ρ0和ρ分别表示处理前后的PVA溶液质量浓度,mg/L。
二、结果与讨论
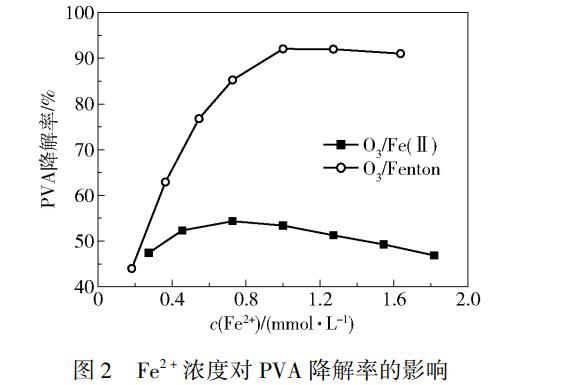
2.1 Fe2+浓度对PVA降解效果的影响
Fe2+浓度对PVA处理效果影响的实验结果如图2所示。由图2可以看出,O3/Fenton工艺的效果明显优于O3/Fe(Ⅱ)工艺。两个工艺的降解率均随着Fe2+浓度的增加先增加后降低,O3/Fenton工艺和O3/Fe(Ⅱ)工艺的最佳Fe2+浓度分别为1.1mmol/L和0.8mmol/L,对应的PVA的最高降解率分别为95.8%和51.7%。在Fe2+浓度小于最佳值时,作为催化剂的Fe2+还未达到饱和,可以和气相O3或液相中的H2O2反应,从而促进•OH的产生,使降解效果不断得到增强,但当Fe2+浓度继续增加,过量的Fe2+会消耗溶液中的•OH,使溶液中的•OH数目减少,影响催化氧化的效果,如式(2)所示,从而使得PVA的降解率有下降的趋势。这一结论与前人的研究结果一致。
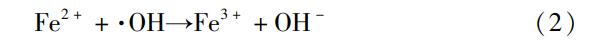
2.2 溶液初始pH对PVA降解效果的影响
溶液初始pH对PVA处理效果影响的实验结果如图3所示。由图3可以看出,在初始pH从1升至10的过程中,PVA的降解率先增加后下降,在pH为2时达到最大值,此时O3/Fenton工艺和O3/Fe(Ⅱ)工艺对应的PVA的降解率分别为99.4%和67.4%。pH为1时H+浓度过大,大量的H+会破坏溶液中Fe2+和Fe3+的氧化还原平衡,见式(3),使大量Fe2+转化为Fe3+,丧失了其催化性能,另外过量的H+也会消耗溶液中产生的•OH。以上原因都会使PVA的降解效果变差。pH由1升至2,作为自由基引发剂的OH-会使O3快速分解产生大量的•OH,另外,O3/Fe(Ⅱ)工艺下Fe2+催化O3生成•OH,O3/Fenton工艺下除了Fe2+催化O3外,H2O2也会分别与Fe2+和O3反应产生•OH,使得PVA降解率增大。随着pH的继续增加,溶液中的OH-浓度增加,Fe2+的稳定性受到影响,部分Fe2+会以沉淀的形式存在,不利于•OH的产生,导致PVA降解率逐渐下降。
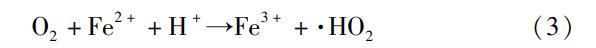
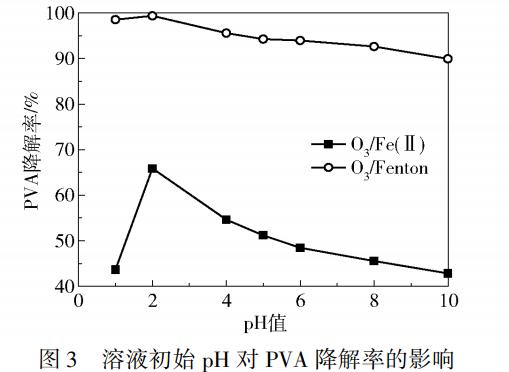
2.3 RPB转速对PVA降解效果的影响
RPB转速对PVA处理效果影响的实验结果如图4所示。由图4可以看出,随着RPB转速的不断提高,O3/Fe(Ⅱ)工艺下PVA的降解率不断增大,转速为1200r/min时的降解率达到50.8%,O3/Fenton工艺下PVA的降解率在转速为1000r/min时达到最大值91.2%。
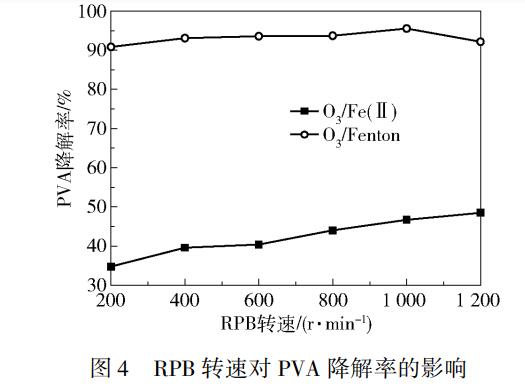
比较O3/Fe(Ⅱ)和O3/Fenton工艺对PVA的处理效果可看出,当转速超过1000r/min时O3/Fenton工艺的处理效果呈现下降的趋势,而O3/Fe(Ⅱ)工艺的处理效果则继续上升。RPB转速对O3/Fe(Ⅱ)和O3/Fenton工艺有两方面的影响:一方面,RPB转速提高可以将废水切割成更薄的液膜和更小的液滴,有利于气液传质,从而改善O3的吸收效果,促进•OH的形成,使PVA降解率提高,另一方面,RPB转速提高使废水流速加大,废水在RPB中的停留时间变短,气液接触时间随之降低,使PVA降解率下降。对于O3/Fenton工艺,当RPB转速为1000r/min时,PVA的降解率已超过90%,O3的吸收效率已经达到较高的水平,随着转速的增加,即使液滴继续变小也难于进一步提高O3的吸收率,而此时废水停留时间变短的影响居于支配地位,导致PVA的降解率随着转速的增加而下降,而在O3/Fe(Ⅱ)工艺中,当RPB转速为1000r/min时,PVA的降解率不高,进一步增加转速,液滴变小会提高O3的吸收效果,促进PVA的降解,这一影响超过废水停留时间变短所带来的不利影响,从而使PVA的降解率随着RPB转速的增加而不断上升。
2.4 反应温度对PVA降解效果的影响
反应温度对PVA处理效果影响的实验结果如图5所示。由图5可看出,随着反应温度的升高,O3/Fenton工艺下PVA的降解率先增加后基本不变,反应温度由20℃上升至40℃,PVA降解率从93.2%增加至98.0%,进一步升高温度至70℃的过程中PVA降解率稳定在98%左右,O3/Fe(Ⅱ)工艺下PVA的降解率则随温度升高而一直增加,在反应温度由20℃上升至70℃时,PVA降解率从59.7%增加至81.0%。温度的升高可以加快•OH与反应物分子之间的碰撞从而加大反应的速率,温度越高,Fe2+在溶液中的溶解效果越好,这些原因都会使PVA降解率升高。O3/Fenton工艺中,O3不仅与Fe2+反应生成•OH,还会和溶液中的H2O2发生反应,所以O3/Fenton工艺下O3在溶液中的溶解情况会对反应产生较大的影响,随着温度的进一步升高,O3在溶液中的溶解度降低,产生的负面影响与反应速率升高带来的正面影响相抵消,使PVA的降解率基本保持不变。
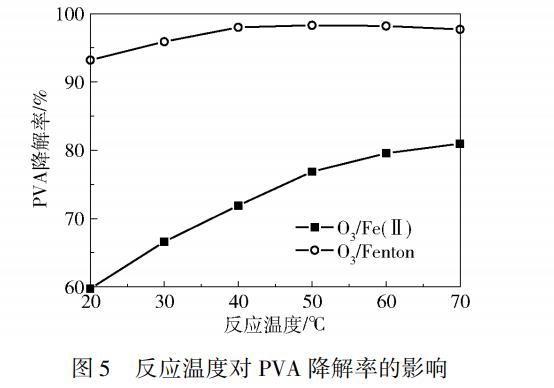
2.5 气相O3质量浓度对PVA降解效果的影响
气相O3质量浓度对PVA处理效果影响的实验结果如图6所示。由图6可以看出,两个工艺下PVA的降解率均随着O3质量浓度的升高而增加,在气相O3质量浓度为60mg/L时,O3/Fenton工艺和O3/Fe(Ⅱ)工艺下PVA的降解率分别达到96.0%和65.5%。这是由于较高的气相O3浓度会增加传质的推动力,促进O3在PVA溶液中的吸收,提高液相O3浓度,从而增强PVA的降解效果。
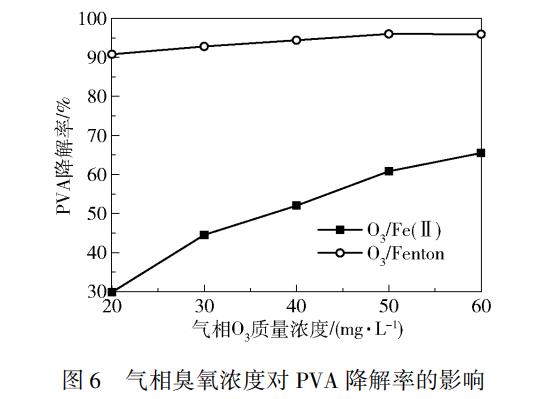
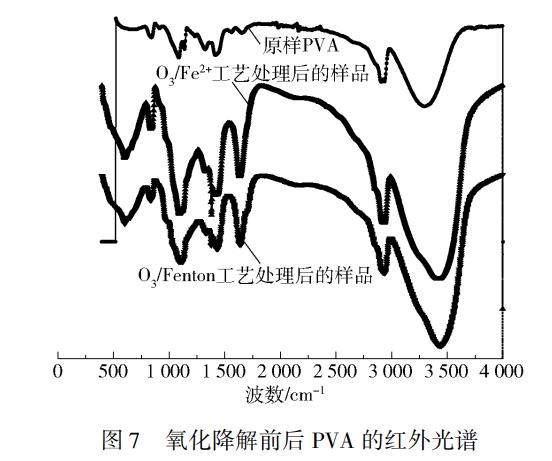
2.6 PVA降解前后的红外光谱分析
将未经处理的PVA和分别通过O3/Fe(Ⅱ)与O3/Fenton两种高级氧化工艺处理后的样品进行红外光谱分析,处理条件与1.2节处所述相同,红外光谱检测结果如图7所示。
由图7可以看出,PVA经处理后产物的红外光谱在1639cm-1处出现较强峰,说明O3/Fe2+和O3/Fenton工艺降解PVA的产物中存在着羰基C=O的特征峰,表明产物中可能存在含有羰基的醛、酮和酸,2600~3600cm-1范围内羟基的特征峰明显变强变宽。由以上两点可以确定产物中羧酸的存在。此外,3424cm-1和3440cm-1处的强峰还可能包括醛基的倍频峰,所以不能排除醛类的存在。通过以上分析可知,PVA被氧化生成羧酸,另外还可能生成醛类等中间产物,证实PVA确实发生了降解。
2.7 降解PVA的动力学分析
O3/Fe(Ⅱ)工艺和O3/Fenton工艺氧化PVA的基本过程均可由式(4)描述。假定两个反应符合一级动力学规律,且由于•OH极不稳定,生成和消耗的速率近似为相等的,所以可以认为•OH的浓度在反应过程中保持恒定,则降解PVA的动力学方程可用式(5)表示。

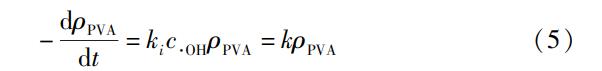
式(5)两边积分,得

式中,ki为•OH与PVA反应的本征反应速率常数,min-1,k为一级动力学表观反应速率常数,min-1,c•OH为•OH的浓度,mol/L,ρPVA为PVA的质量浓度(下文用ρ代替),mg/L,ρPVA,0为初始PVA溶液的质量浓度(下文用ρ0代替),mg/L。
由式(6)可知,若该反应符合一级反应的动力学假设,那么在一定的反应时间内,ln(ρ0/ρ)与反应时间t的曲线应该是线性相关的。本文对该假设进行了实验验证。
利用RPB循环进料,在PVA质量浓度1000mg/L、pH=5.9、液体流量30L/h、气体流量90L/h、Fe2+浓度0.8mmol/L、RPB转速1000r/min、O3质量浓度30mg/L、温度27℃(O3/Fe(Ⅱ)工艺)、温度32℃(O3/Fenton工艺)、H2O2质量浓度25mg/L(O3/Fenton工艺)的条件下考察了PVA浓度随时间的变化规律,结果如图8所示。
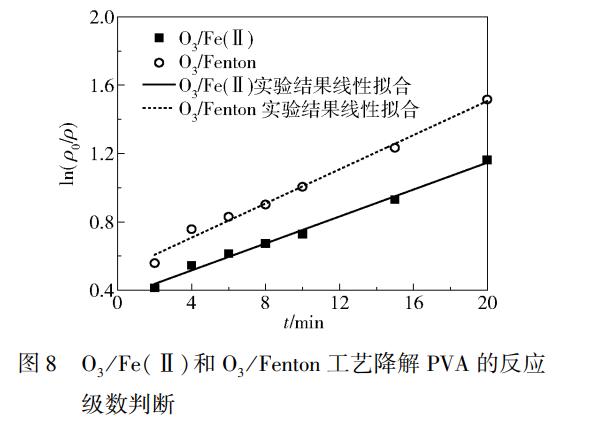
根据图8可以看出,ln(ρ0/ρ)与t呈现出较好的线性相关关系,拟合线性方程如式(7)、(8)所示。
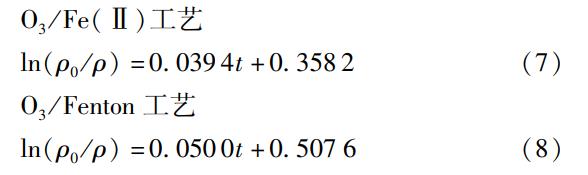
式(7)和式(8)的相关系数分别为R2=0.9920和R2=0.9901,由此可以判断这两个工艺降解PVA的反应均为一级反应。O3/Fe(Ⅱ)工艺降解PVA的一级表观反应速率常数为0.0394min-1,O3/Fen-ton工艺降解PVA的一级表观反应速率常数为0.0500min-1。
三、结论
(1)在RPB中利用O3/Fe(Ⅱ)和O3/Fenton工艺降解PVA,结果表明RPB对于上述工艺降解PVA具有良好的促进作用,这是由于RPB中超重力场对液体的高度分散促进了O3的气液传质过程。
(2)O3/Fenton工艺的处理效果明显优于O3/Fe(Ⅱ)工艺。两种工艺均在pH=2时对PVA具有最好的降解效果,此时O3/Fenton工艺和O3/Fe(Ⅱ)工艺对于PVA的降解率分别为99.4%和67.4%。
(3)O3/Fe(Ⅱ)和O3/Fenton工艺降解PVA的反应均为一级反应,O3/Fe(Ⅱ)和O3/Fenton工艺降解PVA的一级表观反应速率常数分别为0.0394min-1和0.0500min-1。(>
如需要产品及技术服务,请拨打服务热线:13659219533
选择太阳集团城娱8722,你永远值得信赖的产品!
了解更多,请点击www.botaida.com







